近期,基因毒性杂质风波再起,这一次的主角是雷尼替丁,涉事药企为诺华旗下山德士以及Apotex等。雷尼替丁中发现的基因毒性杂质为N-亚硝基二甲胺(NDMA),这个杂质并不是第一次出现,前段时间沸沸扬扬的沙坦类药物也涉及到该基因毒性杂质。
首先,FDA声明提醒患者和医护人员,在雷尼替丁中发现该杂质;紧接,数家药品生产企业(包括品牌药和仿制药),启动召回程序,FDA提示患者和医护人员进行药品召回;最近,FDA更新了雷尼替丁中NDMA检测方法(文末附有新的检测方法)

2019年9月13日,FDA发表声明,提醒患者和医护人员在雷尼替丁中发现NDMA。
美国FDA已获悉,某些雷尼替丁药物,包括一些通常被称为品牌药物Zantac的产品,都含有少量称为N-亚硝基二甲胺(NDMA)的亚硝胺杂质。根据实验室测试的结果,NDMA被归类为可能的人类致癌物(一种可能导致癌症的物质)。NDMA是一种已知的环境污染物,存在于水和食物(包括肉,奶制品和蔬菜)中。
自去年以来,FDA一直在研究血压和心力衰竭药物中的NDMA和其他亚硝胺杂质,称为血管紧张素II受体阻滞剂(ARB)。就ARB而言,由于发现亚硝胺水平不可接受,FDA已建议进行多次召回。
当代理商发现问题时,它会迅速采取适当行动以保护患者。FDA正在评估雷尼替丁中低水平的NDMA是否对患者构成风险。FDA将在可用时发布该信息。
患者应该能够相信自己的药物是尽可能安全的,并且服用这些药物所带来的好处超过了对健康的任何风险。尽管NDMA可能会造成大量危害,但FDA从初步测试中发现的雷尼替丁含量几乎不超过您在普通食品中可能发现的含量。
雷尼替丁是一种非处方药(OTC)和处方药。雷尼替丁是一种H2(组胺2)阻滞剂,可减少由胃产生的酸量。非处方雷尼替丁被批准用于预防和缓解因食酸和胃酸而引起的烧心。雷尼替丁处方被批准用于多种适应症,包括治疗和预防胃和肠溃疡以及治疗胃食管反流疾病。
该机构正在与国际监管机构和行业合作伙伴合作,确定雷尼替丁中这种杂质的来源。该机构正在检查雷尼替丁中NDMA的水平,并评估可能给患者带来的风险。FDA将根据正在进行的调查结果采取适当措施。该代理将在可用时提供更多信息。
FDA目前不要求个人停止服用雷尼替丁。但是,希望停止使用雷尼替丁处方的患者应与医疗保健专业人员讨论其他治疗方案。服用OTC雷尼替丁的人可以考虑使用经批准可用于其病情的其他OTC药物。市场上有多种药物被批准与雷尼替丁具有相同或相似的用途。
消费者和医疗保健专业人员应将雷尼替丁的任何不良反应报告给FDA的MedWatch计划,以帮助该机构更好地了解问题的范围:

2019年9月24日,FDA官网发布消息,因发现含有基因毒性杂质NDMA,Sandoz山德士主动召回14个批次的雷尼替丁胶囊。

2019年9月25日,另外一家知名仿制药企业Apotex,也因NDMA启动了召回,涉及到2个剂量(75mg以及150mg)的多种包装规格的雷尼替丁片。
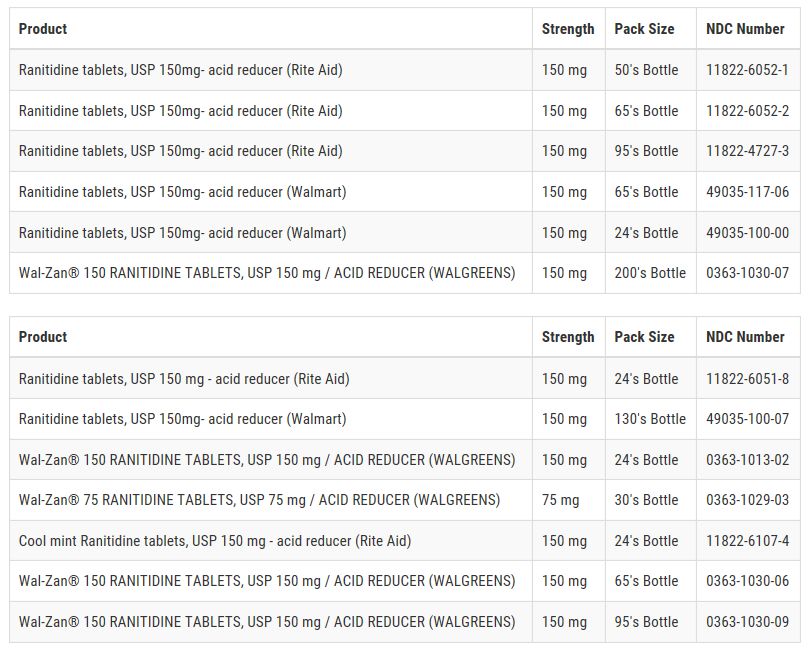
关联消息:
除了雷尼替丁涉及到NDMA杂质外,在2018年,Major、Prinston(华海药业美国子公司)、以及Camber也先后因为该杂质召回过缬沙坦片剂。
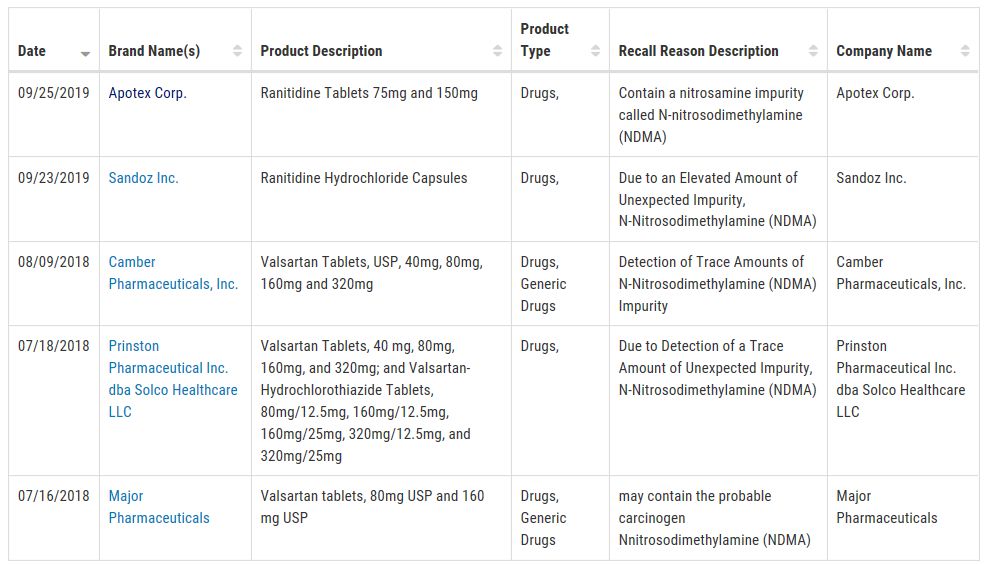
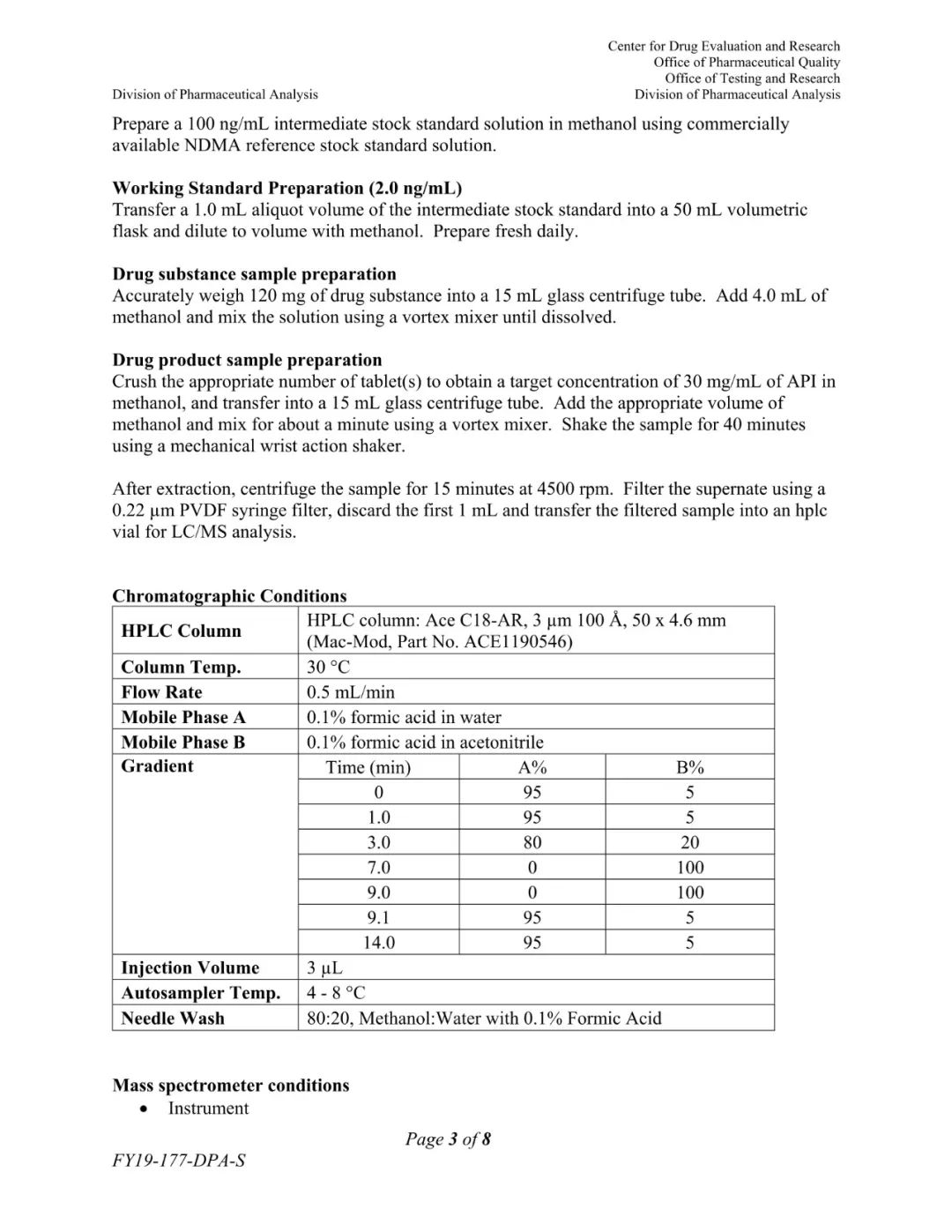
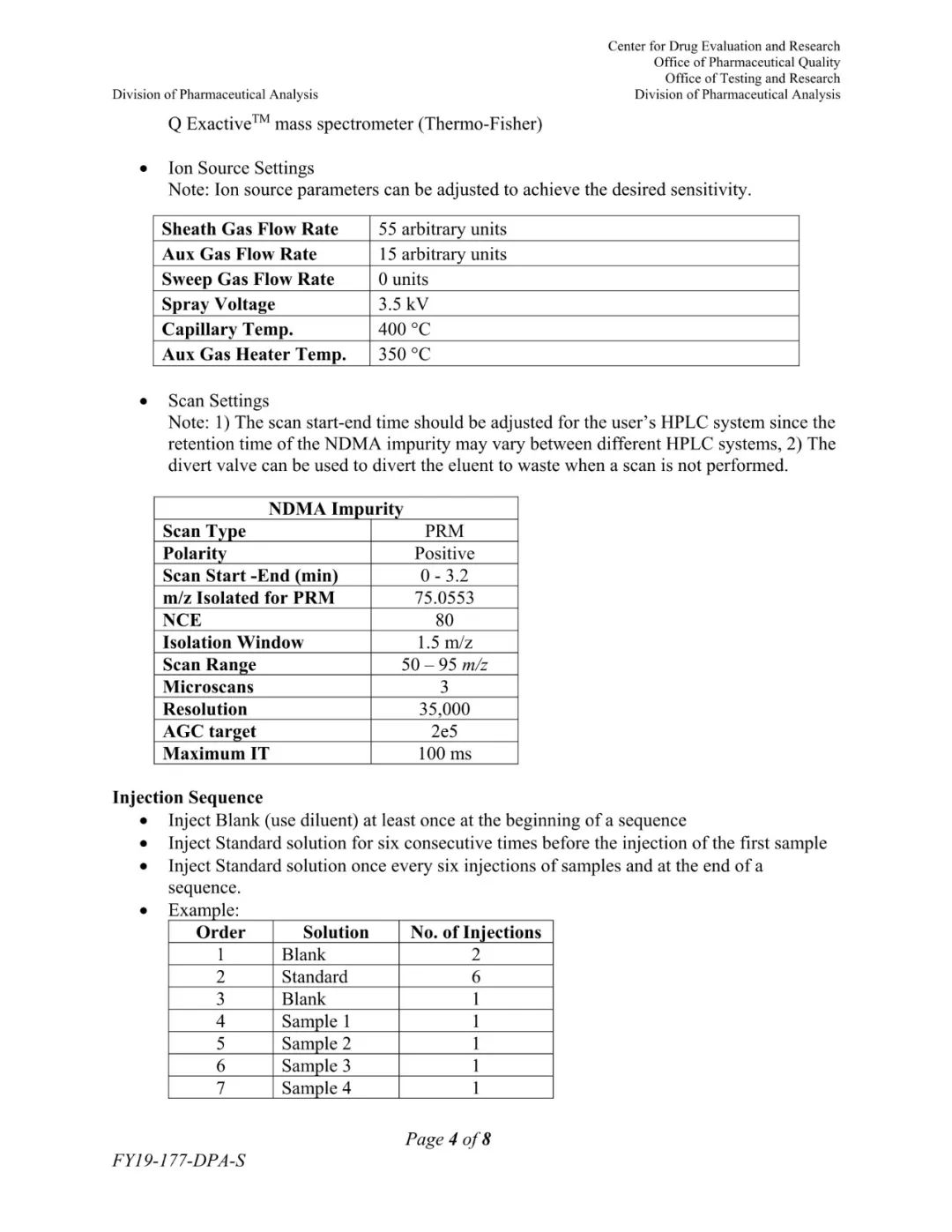
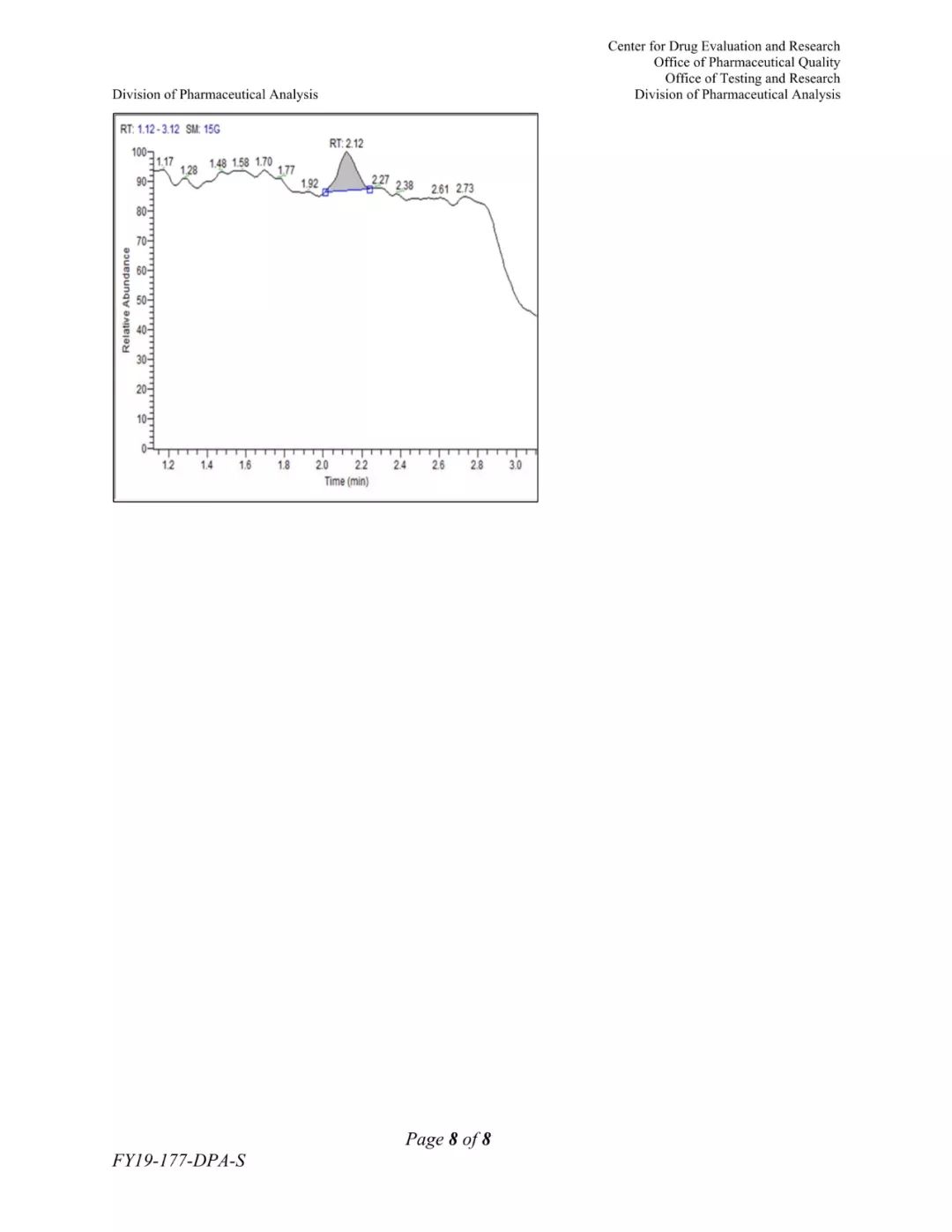
(FDA发布的更新检测方法)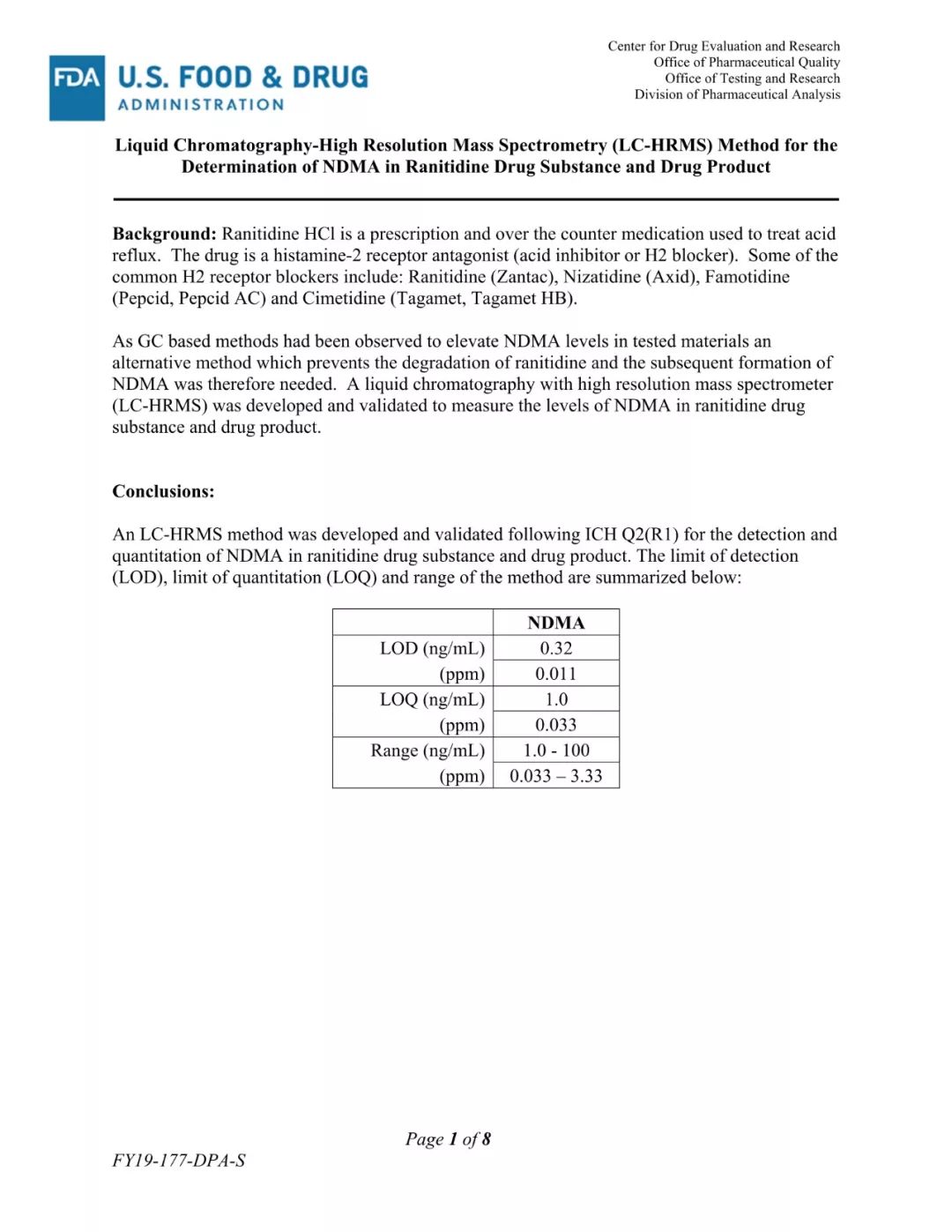




关键词:基因 毒性 FDA
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2024 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1